Dit artikel verschijnt in de januari 2020 editie van National Geographic Magazine.
Ruim dertig jaar geleden werd Tom Norris vanwege kanker bestraald in zijn liesstreek en zijn linkerheup. De kanker verdween en kwam niet meer terug. Maar Norris bleef kampen met een stekende pijn vanuit zijn heup die via zijn ruggengraat doorstraalde tot aan zijn nek.
Sindsdien is er geen dag geweest dat de inmiddels zeventigjarige Norris géén pijn had. Het kostte hem zijn baan als vliegtuigmonteur bij de Amerikaanse luchtmacht. Op slechte dagen is de pijn zo hevig dat hij zijn bed niet uit komt. Op zijn beste dagen krijgt hij simpele dingen, zoals even het vuilnis buiten zetten, niet voor elkaar. En soms is de pijn zo overweldigend dat hij amper lucht krijgt. ‘Dan is het net alsof ik verdrink.’
Norris doet zijn verhaal thuis in een buitenwijk van Los Angeles, vanaf een ligbank met kussens, waarop hij afwisselend zit en gestrekt ligt. Hij is een lange, aardige man, die zijn pijn heeft leren verbergen achter een stalen gezicht. Niet één keer zie ik hem een spiertje vertrekken.
Toen de pijn zijn leven begon te overheersen, had Norris er baat bij om erover te praten. Na verloop van tijd werd hij een spreekbuis voor mensen met chronische pijn en richtte hij een praatgroep op voor lotgenoten. Tegelijkertijd is hij dertig jaar lang blijven zoeken naar iets wat hemzelf hielp. Een tijdlang slikte hij fentanyl, een sterke opioïde die de pijn dempte, maar met als bijeffect dat hij ‘gevloerd was en totaal van de wereld’. Ook probeerde hij acupunctuur, wat enige verlichting gaf, en bijensteken, magneettherapie en gebedsgenezing, wat geen van drieën iets uithaalde. Nu houdt hij het bij fysiotherapie om mobiel te blijven en steroïdeninjecties in zijn ruggengraat ter kalmering van zijn ontstoken zenuwen.
Norris is bepaald niet de enige: alleen al in de VS leven vijftig miljoen mensen met chronische pijn; wereldwijd zijn dat er vele malen meer. De oorzaken zijn heel verschillend, van kanker en diabetes tot neurologische ziekten en andere kwalen. Maar allemaal hebben ze één ding gemeen: hun leven is ontwricht door hun lichamelijk lijden, af en toe of permanent. Sommige kankerpatiënten houden zulke zware, hardnekkige pijn over aan de chemotherapie dat ze liever stoppen met de behandeling en sterven.
De tol van chronische pijn wordt de laatste jaren steeds zichtbaarder. Sinds artsen eind jaren negentig opioïden als oxycodon tegen pijn gingen voorschrijven, zijn honderdduizenden Amerikanen verslaafd geraakt aan deze medicijnen, die behalve als pijnstiller soms ook als genotsmiddel werken. Maar ook nu we de risico’s kennen, zijn er nog steeds veel mensen afhankelijk van opioïden, deels bij gebrek aan alternatieven. Want er zijn al decennialang geen nieuwe effectieve pijnstillers ontwikkeld.
Het misbruik van opioïden, die idealiter kortstondig worden gebruikt tegen acute pijn, heeft in de Verenigde Staten epidemische vormen aangenomen. In 2017 kampten volgens een schatting van de National Survey on Drug Use and Health naar schatting 1,7 miljoen Amerikanen met een verslaving die ooit begon met een doktersrecept. Elke dag sterven in de VS zo’n 130 mensen aan een overdosis opioïden, een triest cijfer waarin zowel legale pijnstillers als heroïne en vergelijkbare drugs zijn meegenomen.
De zoektocht naar de biologie van pijn en naar betere behandelmogelijkheden van chronische pijn is dus urgenter dan ooit. Onderzoekers krijgen een steeds gedetailleerder beeld van de manier waarop pijnprikkels door de gevoelszenuwen worden doorgegeven aan de hersenen en hoe die de pijn vervolgens voelen. Ook is er steeds meer bekend over de rol van bepaalde genen bij de regulering van pijn, wat mede verklaart waardoor pijnbeleving en -tolerantie zo sterk kunnen verschillen.
Deze vorderingen hebben tot een omslag geleid in het wetenschappelijk denken over pijn, en in het bijzonder chronische pijn, waaronder pijn wordt verstaan die minstens drie maanden aanhoudt. Van oudsher werd pijn in de geneeskunde beschouwd als een gevolg van letsel of ziekte, als een neveneffect van iets anders. Maar veel patiënten hebben nog steeds pijn als de kwaal of kwetsuur allang is genezen. Dan is de pijn zélf de aandoening geworden.
De hoop is nu dat dit inzicht en het steeds betere begrip van hoe pijn precies werkt, zullen leiden tot nieuwe behandelmogelijkheden, zoals niet-verslavende alternatieven voor opioïden. Er worden al experimenten gedaan met veelbelovende methoden als hersenstimulatie met lichte elektrische schokjes om de pijnbeleving te beïnvloeden en het pijnremmend vermogen van het lichaam zelf te versterken.
Het is tragisch dat er een ‘maatschappelijke ramp’ voor nodig is geweest om de medische wetenschap wakker te schudden, vindt Clifford Woolf, een neurobioloog in een ziekenhuis in Boston. Maar het voordeel is dat het pijnonderzoek daardoor een flinke impuls heeft gekregen. ‘Ik verwacht dat we binnen een paar jaar veel meer zullen begrijpen van pijn,’ zegt hij.
Het vermogen om pijn te voelen is een geschenk van de natuur aan de mens en de rest van het dierenrijk. Zonder pijn zouden we niet meteen onze hand terugtrekken als we een gloeiendheet fornuis aanraken, of zorgen dat we niet op blote voeten door gebroken glas lopen. Pijn waarschuwt voor gevaar.
De schildwachten in dit waarschuwingssysteem zijn de nociceptoren, speciale gevoelszenuwen die dicht bij het ruggenmerg liggen. Ze hebben uitlopers naar huid, longen, darmen en andere delen van het lichaam. Ze kunnen verschillende soorten gevaarlijke prikkels waarnemen: een messteek, de hitte van druipend kaarsvet, het branden van zuur. Zodra de nociceptoren zo’n bedreiging ontwaren, sturen ze elektrische seintjes naar het ruggenmerg, dat ze vervolgens via andere neuronen aan de hersenen doorgeeft. Neuronen van een hogere orde in de cortex – die het eindpunt vormen van de opstijgende pijnbaan, die van de ruggengraat naar de hersenen loopt – zorgen er tenslotte voor dat we de pijn voelen.
Zodra de hersenen de pijn opmerken, proberen ze daar een eind aan te maken. Neurale netwerken in de hersenen sturen elektrische signalen via het ruggenmerg langs de afdalende pijnbaan, waardoor endorfinen en andere natuurlijke opioïden vrijkomen. Deze biochemische stofjes onderdrukken de pijnsignalen naar de hersenen, waardoor de pijn minder wordt.
Dit schema van opstijgende en afdalende pijnbanen was al uitgedokterd toen Woolf in de jaren tachtig als onderzoeker aan de slag ging. Woolf trok zich het lijden van de patiënten die hij als arts in opleiding op de chirurgische afdeling zag erg aan. ‘Het was duidelijk dat ze verschrikkelijke pijn hadden,’ vertelt hij. Maar de arts die de leiding had leek het de patiënten haast kwalijk te nemen dat ze klaagden. Woolf: ‘Ik zeg tegen die arts: ‘Waarom doet u niets?’ Zegt die arts: ‘Tja, wat wil je, ze zijn net geopereerd. Het gaat vanzelf over.’
‘Pijn was een probleem waarvoor de medische stand geen oog had, vooral omdat er toch niet veel aan te doen viel,’ zegt Woolf. Toen hij dat doorhad, besloot hij uit te zoeken hoe pijn precies werkt. Hij begon experimenten te doen bij ratten om te kijken hoe pijn wordt doorgegeven en zag dat er neuronen actief werden in het ruggenmerg als de diertjes hittestootjes op hun huid werden toegediend. Hij zag dat de neuronen sterk reageerden op de signalen van de nociceptoren, zoals hij al had verwacht. Maar Woolf ontdekte ook iets waarop hij niet had gerekend. Nadat een stukje huid een paar keer zo’n hittestoot had gekregen en ontstoken was geraakt, vertoonden de neuronen in het ruggenmerg een verhoogde gevoeligheid. Een lichte aai over dat plekje was dan al genoeg om de neuronen te activeren.
Dit toonde aan dat de schade aan de huid het centrale zenuwstelsel gevoeliger had gemaakt: nu stuurden de neuronen in het ruggenmerg al bij de geringste aanraking pijnsignalen naar de hersenen. Inmiddels is aangetoond dat dit verschijnsel, centrale sensitisatie genoemd, zich ook bij mensen voordoet en tot verschillende soorten pijn kan leiden, zodat een gebied rond een snij of een brandwond al zeer doet als je er bij wijze van spreken naar kijkt.
Een verrassende conclusie van Woolfs onderzoek, die later door anderen werd bevestigd, was dat pijn ook kan optreden als er geen weefselschade is. Dat logenstrafte het idee van sommige artsen dat patiënten die over pijn klaagden waarvoor geen lichamelijke verklaring was, zich aanstelden, om pijnstillers te krijgen die ze niet nodig hadden, bijvoorbeeld, of om medelijden te oogsten. Het mechanisme van pijnoverdracht kan ontregeld raken na een verwonding, zoals bij de ratten, maar het kan ook vanzelf op tilt slaan of overgevoelig blijven als een wond allang is genezen. Dat gebeurt bijvoorbeeld bij mensen met neuropathische pijn, fibromyalgie of prikkelbaredarmsyndroom. Bij deze patiënten is pijn geen symptoom, maar een aandoening op zichzelf, veroorzaakt door een verkeerd afgesteld zenuwstelsel.
Nu het mogelijk is om in het laboratorium menselijke stamcellen te kweken, kunnen Woolf en zijn collega’s allerlei soorten menselijke neuronen maken, met inbegrip van nociceptoren. Dankzij deze doorbraak is veel preciezer onderzoek mogelijk naar neuronen om een beter beeld te krijgen van de omstandigheden waarin ze ‘pathologisch gevoelig’ worden, zoals Woolf zegt, en spontaan signalen gaan sturen.
Bij gekweekte nociceptoren hebben Woolf en collega’s kunnen bestuderen hoe het komt dat cytostatica, de medicijnen die worden gebruikt voor chemotherapie, neuropathische pijn veroorzaken. Nociceptoren die aan deze middelen worden blootgesteld, reageren sneller en raken beschadigd. Dat is waarschijnlijk een van de oorzaken van de neuropatische pijn waar veertig procent van alle chemopatiënten last van krijgt.
Andere onderzoekers hebben ontdekt dat deze signalen maar één van de factoren is die bepalen hoe hersenen pijn beleven. Pijn, zo blijkt, is een heel complex en subjectief verschijnsel, dat medeafhankelijk is van de persoon – en diens brein – die het ondergaat. Ook iemands gemoedstoestand kan meespelen, net als de omstandigheden waarin de pijn optreedt. Zo kan spierpijn na een stevige sporttraining een tevreden gevoel geven, of smaakt gekruid eten dat brandt op je tong juist naar méér.
‘We hebben onvoorstelbaar veel invloed op de manier waarop we zulke binnenkomende prikkels verwerken,’ zegt Irene Tracey, neurowetenschapper aan de University of Oxford. Tracey, een ervaren spreker die een salvo aan snelle zinnen afvuurt, heeft zich een groot deel van haar loopbaan beziggehouden met de mysterieuze link tussen weefselschade en pijn. ‘Dat is zeker geen eenopeenrelatie. Er zijn een heleboel dingen die het erger maken, of beter, of anders,’ legt ze uit.
Tracey heeft met haar collega’s experimenten uitgevoerd waarbij hersenscans van vrijwilligers werden gemaakt terwijl hun huid werd bloot gesteld aan speldenprikken, hittestoten of een lik crème met capsaïcine, het stofje dat rode peper zo scherp maakt. Het leverde een veel complexer beeld op van pijnbeleving dan ze hadden verwacht. In plaats van één enkel pijncentrum in de hersenen blijken allerlei gebieden betrokken te zijn bij de reactie op pijnlijke prikkels, waaronder netwerken die ook een rol spelen bij emoties, cognitie, herinneringen en het nemen van beslissingen.
Ook ontdekten ze dat dezelfde prikkel niet steeds leidt tot dezelfde reactie, wat erop duidt dat iemand hetzelfde letsel de ene keer pijnlijker kan vinden dan de andere. Door die flexibiliteit kunnen we onze pijndrempel aanpassen, wat bijvoorbeeld handig kan zijn om even een kop hete soep uit de magnetron op het aanrecht te zetten. Ons brein weet dat het erger zou zijn als we de kop soep uit onze handen zouden laten vallen en zorgt daarom dat we de hitte een paar tellen kunnen verdragen.
Andersom kunnen angst, spanning en verdriet pijn juist heviger maken, stelden Tracey en haar collega’s vast. Bij een van hun experimenten lieten ze studenten het treurige muziekstuk Rusland onder het juk der Mongolenvan Prokofjev horen, vertraagd afgespeeld, en teksten lezen als ‘Mijn leven is mislukt’. Tegelijkertijd werd een met capsaïcine ingesmeerde plek op hun linkeronderarm aan hitte blootgesteld. Daarna kregen ze dezelfde pijnprikkels, maar nu met vrolijke muziek en neutrale mededelingen als ‘Kersen zijn fruit’. Het trieste scenario werd als ‘onaangenamer’ ervaren.
Bij vergelijking van de hersenscans van de studenten in beide stemmingen, zagen de onderzoekers dat droefenis niet alleen invloed had op het netwerk dat emoties reguleert, maar ook andere delen van het brein activeerde. Dat duidt erop dat pijn fysiek sterker wordt gevoeld door verdriet. ‘We hebben mensen angstig en gespannen gemaakt,’ zegt Tracey, ‘en aangetoond dat de signalen daardoor versterkt binnenkomen.’
Jo Cameron zou zware pijnstillers nodig hebben na een operatie aan haar hand wegens artritis, had de anesthesist haar laten weten. Maar daar dacht de 66-jarige Schotse anders over. ‘Wedden dat ik geen pijnstillers hoef?’ had ze daarop geantwoord.
De anesthesist keek haar aan alsof ze niet goed wijs was. Uit ervaring wist hij hoe erg de pijn na zo’n ingreep kon zijn. Toen hij na afloop bij haar kwam kijken, bleek ze zelfs het lichte middel dat hij had voorgeschreven niet te hebben genomen. ‘U hebt niet eens paracetamol geslikt, hè,’ zei hij. ‘Nee,’ antwoordde Cameron vrolijk, ‘dat zei ik toch al?’
Als kind was ze vaak verbaasd dat ze blauwe plekken had zonder te weten hoe ze daaraan was gekomen, vertelt Cameron. Toen ze haar twee kinderen kreeg, beviel ze beide keren zonder een centje pijn.
‘Ik weet eigenlijk niet wat pijn is,’ zegt ze. ‘Ik kan het wel aan mensen zien als ze pijn hebben, aan hun vertrokken gezicht, hun gespannen reactie. Maar ik heb dat zelf nooit gehad.’
Cameron hoort tot de zeldzame categorie mensen die de wetenschap helpt bij het ontrafelen van de genetische kant van pijnbeleving. James Cox van het London University College onderzocht haar DNA en constateerde twee mutaties in twee naast elkaar gelegen genen. Die mutaties bleken de afbraak te remmen van de neurotransmitter anandamide, die helpt bij het verzachten van pijn. Doordat ze over te veel anandamide beschikt, voelt Cameron geen pijn.
Cox houdt zich al bezig met mensen zoals Cameron sinds zijn postdoctorale opleiding in Cambridge, vijftien jaar geleden. Via zijn begeleider, Geoffrey Woods, hoorde hij over een tienjarig jochie in Pakistan dat als straatartiest geld verdiende door zonder te blikken of blozen blootsvoets over gloeiende kolen te lopen en messen in zijn armen te steken. Na afloop liet hij dan zijn verwondingen behandelen in het ziekenhuis. De jongen zelf is nooit wetenschappelijk onderzocht; hij maakte een noodlottige val van het dak toen hij met zijn vriendjes aan het spelen was. Maar Cox en collega’s analyseerden wel het DNA van zes kinderen uit dezelfde familie, die ook nooit pijn voelden. Al die kinderen hadden een mutatie in het gen SCN9A, dat een rol speelt bij het doorgeven van pijnsignalen.
Het gen maakt een eiwit aan dat betrokken is bij de transmissie van pijnsignalen van de nociceptoren naar het ruggenmerg. Dat eiwit, Nav1.7, zit aan de buitenkant van het neuron en fungeert als doorvoerkanaal voor natriumionen, die de pijnsignalen in de vorm van elektrische impulsen doorgeven via de zenuwvezel die de verbinding vormt met een ander neuron in het ruggenmerg.
Door de mutaties die de onderzoekers vonden in het gen SCN9A ontstaan misvormde varianten van het eiwit Nav1.7, die de doorgifte van natriumionen aan de nociceptorische
neuronen blokkeren. Doordat hun nociceptoren geen pijnsignalen doorgeven, voelden de kinderen er niets van als ze op hun tong beten of zich ergens aan brandden. ‘Het mooie aan werken met zulke zeldzame families is dat je precies kunt aanwijzen welk gen gemuteerd is,’ zegt Cox, ‘zodat je een op mensen gevalideerde pijnstiller kunt ontwikkelen die zich daarop richt.’
Mutaties in het gen SCN9A spelen ook een rol bij de zeldzame erfelijke aandoening erytromelalgie, in het Engels ook wel het man on fire syndromegenoemd. Patiënten die hieraan lijden, hebben het tegenoverstelde van gevoelloosheid: een permanente branderigheid aan hun handen en voeten en in hun gezicht. In een warme omgeving of bij een geringe inspanning is het branderige gevoel ondraaglijk, alsof ze hun hand boven een vlam houden.
Pamela Costa (53), een klinisch psycholoog uit Tacoma, in de buurt van Seattle, heeft erytromelalgie en zegt dat de pijn ‘onontkoombaar’ is. Om er zo weinig mogelijk last van te hebben, houdt ze de temperatuur in haar werkkamer onder de zestien graden. Slapen lukt alleen met vier ventilators rond haar bed en de airconditioning op vol vermogen. Paradoxaal genoeg heeft ze, juist door die constante branderigheid, hetzelfde probleem als mensen die geen pijn voelen: ze heeft het niet in de gaten als ze iets heets aanraakt. Daardoor heeft ze vorig jaar bij het strijken haar arm verbrand.
‘Ik had het pas door toen ik mijn arm hoorde sissen,’ vertelt ze. ‘Het deed niet meer pijn dan ik toch al had.’
Stephen Waxman, neuroloog aan de Yale University School of Medicine en een autoriteit op het gebied van zenuwgeleiding, heeft Costa en een aantal lotgenoten onderzocht. Waxman is een beminnelijke man die geanimeerd vertelt en verrassend vrolijk is voor iemand die van pijn zijn levenswerk heeft gemaakt. Net als een ander onderzoeksteam, heeft hij samen met collega’s vastgesteld dat erytromelalgiepatiënten mutaties hebben in het gen SCN9A. Maar door die mutaties gebeurt het omgekeerde als bij de bijzondere kinderen uit Pakistan: hun Nav1.7-kanalen gaan te makkelijk open, waardoor natriumionen ook pijnsignalen versturen als er niets aan de hand is.
Aan de hand van laboratoriumproeven met neuronen in petrischaaltjes wist Stephen Waxmans team aan te tonen dat het dit mechanisme is dat bij mensen met Costa’s SCN9A-mutatie de ellende veroorzaakt. ‘We zijn er in het lab in geslaagd om die kanalen in de neuronen te stoppen,’ vertelt Waxman over de explosie van activiteit door de onafgebroken instroom van natriumionen. Bij erytromelalgiepatiënten zorgt deze afwijking ervoor dat de nociceptoren de hersenen aan één stuk door met pijnsignalen bestoken.
De ontdekking dat Nav1.7 de sluizen voor nociceptieve pijnsignalen kan openzetten of afsluiten maakt dit kanaal een aantrekkelijk doelwit voor onderzoekers op jacht naar nieuwe pijnstillers zonder het verslavende effect van opioïden. Opioïden werken doordat ze zich binden aan een eiwit aan de buitenkant van zenuwcellen, de mu-opioïdereceptor, waardoor die receptor communiceert met eiwitten in de cel. Sommige van die eiwitten hebben een pijnstillende werking, maar andere veroorzaken een euforische roes. Doordat het lichaam een tolerantie voor deze middelen opbouwt, zijn steeds hogere doses nodig om dat lekkere gevoel te krijgen, en dat kan tot verslaving leiden.
Omdat Nav1.7 alleen in neuronen zit die weefselschade waarnemen, kan een pijnstiller die het kanaal afsluit heel effectief zijn. Voor zover bekend is er maar één bijwerking, namelijk reukverlies. Mensen met de mutatie kunnen immers ook niet ruiken. Bestaande middelen voor lokale verdoving, zoals lidocaine, blokkeren alle negen natriumkanalen in het lichaam tegelijk, ook de kanalen die een belangrijke rol spelen bij allerlei hersenfuncties, en dat is de reden waarom het alleen wordt gebruikt als patiënten slechts kort verdoofd hoeven te worden. Farmaceutische bedrijven zoeken daarom naar stoffen die Nav1.7 kunnen blokkeren zonder de andere natriumkanalen af te sluiten. Maar tot dusver heeft dat weinig succes opgeleverd.
Toch heeft Waxman goede hoop dat het onderzoek uiteindelijk tot betere middelen zal leiden. ‘Ik heb er alle vertrouwen in dat er een nieuwe, betere groep pijnstillers komt die niet verslavend is,’ zegt hij met twinkelende ogen. Dan zwijgt hij even, tempert zijn enthousiasme. ‘Maar pin me niet vast op een tijdpad.’
Terwijl de speurtocht naar nieuwe middelen doorgaat, zijn er ook artsen en wetenschappers die zich richten op het vermogen van de hersenen zelf om pijn en de bijkomende narigheid te verminderen. En dat vermogen is best indrukwekkend. Lichaam en geest gaan immers al veel langer met pijn om dan dat er studie naar wordt verricht.
Neem het recente Britse onderzoek onder ruim driehonderd patiënten met schouderpijn die in verband wordt gebracht met een osteofyt, een vergroeisel op een bot. Zo’n osteofyt wordt vaak operatief verwijderd met als doel om de pijn weg te nemen. Bij de Britse studie werden de patiënten willekeurig in drie groepen verdeeld. Bij één groep werd de osteofyt weggehaald. Bij de tweede gebeurde dat niet, maar werd de patiënten verteld dat het wel zo was. De derde groep kreeg alleen te horen dat ze na drie maanden terug moesten komen bij de specialist. De patiënten uit groep één en groep twee meldden een vergelijkbare verbetering van hun klachten.
‘Dat de patiënten minder pijn hebben, komt enkel en alleen door het placebo-effect. De ingreep op zich doet niets tegen de pijn,’ zegt Irene Tracey uit Oxford, een van de auteurs van de studie.
Toch maakt dat de uitkomst niet minder relevant, zegt Tracey, omdat eruit blijkt dat het placebo-effect inderdaad werkt. Het onderzoek toont aan hoe belangrijk het is dat de patiënt vertrouwen heeft in de behandeling. ‘Dit is een ijzersterk bewijs dat pijn wordt beïnvloed door verwachtingen.’
Ander onderzoek laat zien wat er gebeurt bij patiënten die ervan uitgaan dat hun pijn minder zal worden en vervolgens daadwerkelijk verlichting ervaren. Hun afdalende pijnbaan wordt geactiveerd, waardoor er in hersenen opioïden vrijkomen die de pijnsignalen vanuit het lichaam temperen.
Dat is dus geen zelfbedrog,’ zegt Tracey. ‘Het placebomechanisme zet dit enorm krachtige proces in het brein in werking.’
Onze beleving van pijn berust niet louter op fysieke waarneming. Ook gevoelens van angst, spanning en ongemak spelen een rol. Een experiment in de Cleveland Clinic onder leiding van neurochirurg Andre Machado richtte zich op die emotionele component bij tien patiënten met chronische neuropatische pijn na een beroerte die met diepe hersenstimulatie (DBS) werden behandeld. Elektroden werden geïmplanteerd in een deel van de hersenen dat betrokken is bij de verwerking van emoties. Ze werden aangesloten op een apparaatje dat in de borst was aangebracht, waarna de elektroden bijna tweehonderd keer per seconde heel lichte schokjes afgaven in het hersengebied. Machado: ‘Bij een aantal patiënten zagen we een verbetering van hun kwaliteit van leven, welbevinden en onafhankelijkheid, al hadden ze nog evenveel pijn.’
Patiënten die hun pijn een negen hadden gegeven op een schaal van tien, hielden dezelfde score, maar gaven toch aan dat ze veel beter functioneerden. Een van de proefpersonen, Linda Grubb, spreekt van een wereld van verschil. ‘Ik ben nu veel mobieler,’ zegt ze, terwijl ze voor de behandeling hele dagen op de bank lag door de pijn. ‘En ik heb veel meer energie. Het heeft mijn leven echt radicaal veranderd.’
Een vervolgexperiment met pijnpatiënten en gezonde proefpersonen gaf Machado en zijn team inzicht in hoe het komt dat mensen als Grubb baat hebben bij diepe hersenstimulatie. De onderzoekers maten de elektrische activiteit in de hersenen van de deelnemers met twee apparaatjes die aan hun armen waren bevestigd. Het ene gaf een hittestoot op de huid, het andere alleen een onschuldige zoemtoon. Op een beeldscherm zagen de deelnemers welke van de twee apparaatjes actief zou worden, of dat er, optie drie, niets ging gebeuren.
De onderzoekers vergeleken de hersenactiviteit van de deelnemers bij hitte, gezoem of gewoon niks, en merkten dat de hersenen van chronische pijnpatiënten hetzelfde reageerden als ze zich voorbereidden op een pijnlijke of een onschuldige prikkel. Bij de gezonde deelnemers zagen ze alleen een verhoogde hersenactiviteit als die zich schrap zetten voor een hittestoot. Toen het experiment bij de pijnpatiënten werd herhaald terwijl ze een DBS-behandeling kregen, leek hun hersenactiviteit meer op die van de gezonde proefpersonen.
Volgens Machado en zijn team duidt dit erop dat de hersenen van chronische pijnpatiënten geconditioneerd zijn door de voortdurende pijn. Zo reageren ze alsof elke prikkel pijnlijk kan zijn en kunnen ze zich nooit echt ontspannen. De DBS-behandeling lijkt dat patroon te doorbreken, zegt Machado, waardoor de hersenen ‘weer onderscheid maken tussen pijnlijk en pijnloos, en dat is nodig om te kunnen functioneren’.
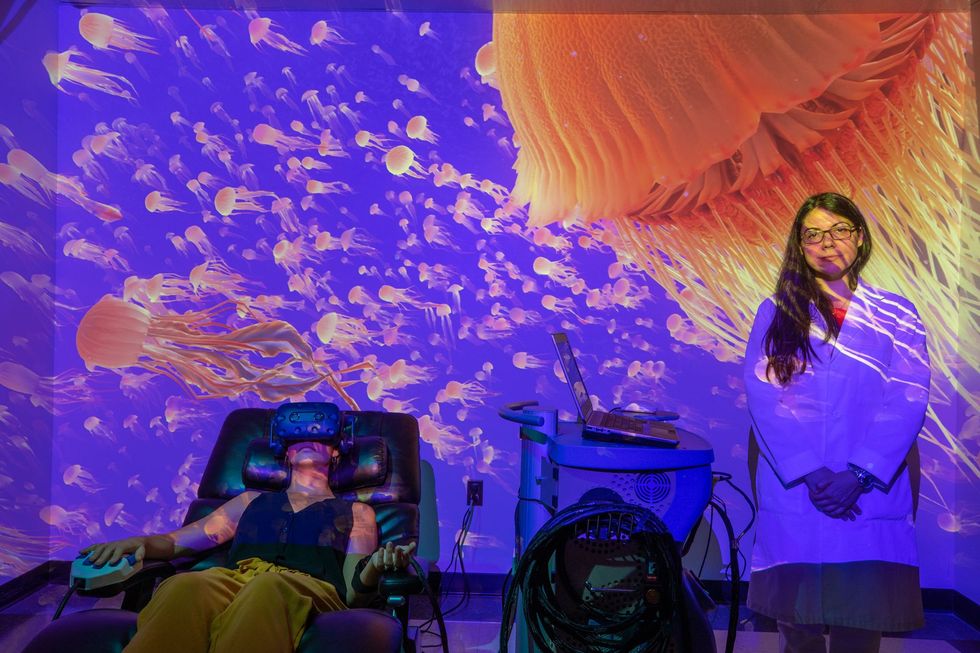
Ook virtual reality kan pijn verminderen. De kracht van deze techniek ervaar ik aan den lijve in het laboratorium van Luana Colloca, een neurowetenschapper aan de University of Maryland. Een van haar assistenten bindt een kastje op mijn linkeronderarm, terwijl ik langzaam wegzak op een comfortabele stoel. Het apparaatje lijkt op het ding dat Machado gebruikt: het is via een kabeltje aangesloten op een computer en kan in een oogwenk warm of juist koud worden. In mijn rechterarm heb ik een afstandsbediening waarop ik een knopje kan indrukken als mijn arm te heet wordt. ‘U hoeft niet bang te zijn dat u verbrandt, hoor,’ stelt de assistent me gerust.
Om proef te draaien moet ik eerst een paar keer op het knopje drukken zodra ik het apparaatje warm voel worden. Bij de volgende reeks mag ik van Colloca pas drukken als de warmte onprettig wordt. Bij de laatste serie mag ik pas opgeven als ik het echt niet meer uithoud.
Vervolgens begint alles van voren af aan, alleen heb ik nu een virtualrealitybril op gekregen waardoor ik me ineens in een onderwaterwereld waan. Terwijl ik een relaxed muziekje te horen krijg, zie ik oogverblindende kwallen voorbijdrijven in het licht dat van boven in het water schijnt. Alleen het warmteapparaatje op mijn arm herinnert me er af en toe even aan dat ik niet echt aan het snorkelen ben.
Na afloop van het experiment laat Colloca me zien welke temperaturen ik heb doorstaan. Met VR-bril scoorde ik bij ‘warm’, ‘heet’ en ‘ondraaglijk’ aanzienlijk hoger dan zonder. De toptemperatuur die ik aankon was met 1,5 graad gestegen tot 47,7 oC, ‘echt loeiheet’, volgens Colloca.
‘Dat betekent dat je veel meer pijn kon verdragen in die mooie omgeving met die rustgevende muziek,’ zegt ze.
Hoe het komt dat virtual reality zo’n gunstige invloed heeft op de pijndrempel, is nog geen uitgemaakte zaak. Sommige wetenschappers denken dat het met afleiding te maken heeft: er worden netwerken aangesproken die anders bezig waren geweest met het doorgeven en waarnemen van pijn. Anderen leggen een verband met het positieve effect op de stemming en emoties.
Colloca heeft aangetoond dat de amusementswaarde patiënten helpt te ontspannen, waardoor ze minder schrikachtig zijn. Waar het effect van virtual reality ook precies op berust, artsen gebruiken het al bij patiënten met acute pijn, bijvoorbeeld door brandwonden. Colloca is ervan overtuigd dat het ook werkt bij de behandeling van chronische pijn.
Tom Norris leidt eens in de maand een praatgroep die hij een paar jaar geleden heeft opgericht in samenwerking met de American Chronic Pain Association. De bijeenkomsten zijn bedoeld als een informele vorm van groepstherapie, vanuit het wetenschappelijk bewezen idee dat gedachten en gevoelens effect hebben op pijnbeleving.
Ik schuif aan bij zo’n bijeenkomst in een kerk in Los Angeles, waar Norris de mensen een voor een aan me voorstelt. (Met het oog op hun privacy vraag ik niet naar achternamen.) Een van de deelnemers, Brian, geeft me een hand. Als ik vertel dat ik alleen kom luisteren, zoals ik ook bij de anderen heb gedaan, grapt hij: ‘Misschien moeten we je een knal voor je hersens verkopen, dan voel je tenminste met ons mee.’
We zijn in totaal met z’n tienen – vijf mannen en vijf vrouwen. We zetten onze stoelen in een kring en nemen plaats. Norris gaat zitten en vraagt hoe het met iedereen is.
Brian, die hevige buikpijn heeft waarvoor de artsen geen oorzaak hebben kunnen vinden, steekt als eerste van wal. Hij vertelt dat hij een jiujitsu-les heeft gedaan en daardoor zijn pijn even kon vergeten. ‘Best wrang dat ik mezelf op een andere manier moet kwellen om even van deze pijn af te zijn,’ lacht hij. ‘Ik heb de hele week aan jullie gedacht. Dat heeft ook geholpen.’
Iedereen in de groep kent elkaars verhalen wel. Maar de stilzwijgende afspraak lijkt dat iedereen een even aandachtig oor krijgt, ook als er niets nieuws te vertellen valt. ‘Vandaag heb ik een zelfmoordhulplijn gebeld,’ zegt Jane. Ze heeft onder meer fybromyalgie en complex regionaal pijnsyndroom. ‘Ik heb al zo veel tegen mijn vrienden lopen klagen dat ik ze niet meer wil lastigvallen.’
Norris zegt dat ze hem altijd kan bellen, net als de anderen. ‘Soms wil je gewoon even gillen.’ Dan kijkt hij een andere vrouw aan die eerder heeft verteld dat ze het lastig vindt om stoom af te blazen. ‘Dus gooi het er maar uit.’
Na afloop van de bijeenkomst wacht Norris tot iedereen weg is en doet vervolgens het licht uit. Ik vraag wat hem motiveert om deze maandelijkse gesprekken te organiseren. ‘Ik merk dat anderen iets aan mijn ervaringen hebben,’ zegt hij. Maar zelf heeft hij er ook baat bij, geeft hij toe. ‘Het geeft me het gevoel dat ik nog steeds iets kan betekenen voor de samen- leving, en dat ik niet de enige ben die worstelt met chronische pijn.’
Yudhijit Bhattacharjee schrijft sinds 2017 voor National Geographic en is auteur van de non-fictiethriller The Spy Who Couldn’t Spell. David Guttenfelder, Robert Clark, Robin Hammond en Craig Cutlerwerken geregeld voor het Magazine. Mark Thiessen is National Geographic-fotograaf.